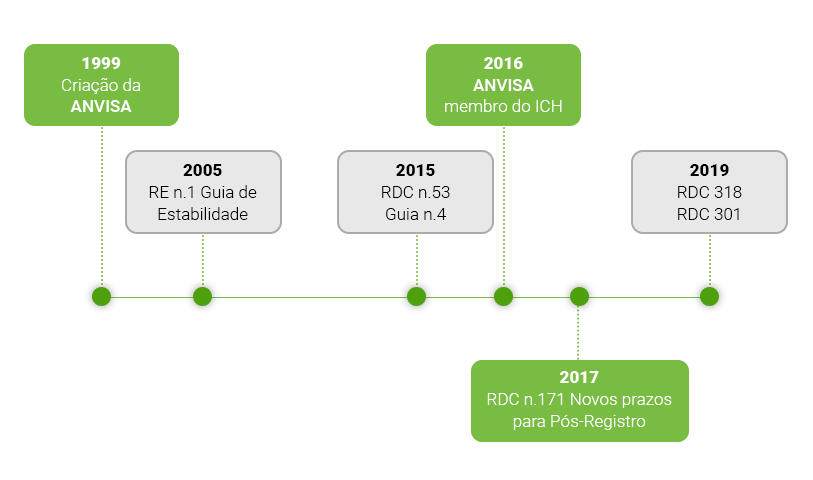
Ao que poucos costumam relembrar, a história da ANVISA é recente (acredito que podemos assim dizer), pois a agência foi idealizada em 1999 (apenas 22 anos desde sua criação) e algumas resoluções e acontecimentos mostrados na imagem acima possuem forte influência na exigências de padrões de referência aqui no Brasil:
Na minha visão, estas são as principais resoluções e fatos que contribuíram para o grande uso de padrões de referência e a extrema exigência da qualidade dos mesmos. Assim sendo, podemos seguir com nosso tema principal: Uso, Importância, Aplicação e Obtenção dos padrões de referência.
De acordo com o que preconiza a ANVISA na RDC 166, Capítulo III, Art 14º: “Na validação de métodos analíticos, deverá ser utilizada Substância Química de Referência Farmacopeica (SQF) oficializada pela Farmacopeia Brasileira, preferencialmente, ou por outros compêndios oficialmente reconhecidos pela Anvisa.
§ 1º. Será admitido o uso de Substância Química de Referência Caracterizada (SQC), mediante a apresentação de relatório de caracterização conclusivo para o lote em estudo, incluindo as razões técnicas para escolha dos ensaios utilizados e os dados brutos pertinentes”
Com esta informação, iniciamos a explicação do uso dos padrões de referência, podendo até mesmo apontar que sua existência passou a ser descrita de maneira técnico-oficial mediante esta informação. A RDC 166 de 2016 foi um marco extremamente importante para as indústrias farmacêuticas no que diz respeito ao uso de padrões de referência, pois com esta resolução, passaram a ter maior gama de escolha e compra de padrões de referência, deixando de lado a centralização de escolha e compra apenas dos padrões de referência farmacopeicos.
Com esta informação podemos também refletir sobre a importância e aplicação dos padrões de referência. Analisem a frase: “Os padrões de referência são utilizados no desenvolvimento de métodos analíticos para quantificação e identificação dos insumos farmacêuticos e suas impurezas, além do controle de qualidade de matérias primas e produtos acabados”. A frase é clara por si só, o padrão de referência é o agente que irá ajudar as indústrias farmacêuticas a provar e controlar a qualidade de seus produtos. Com esta frase conseguimos entender a importância e aplicação de uma única vez.
Mas então como um produto tão importante assim pode ser produzido?
Identificado a necessidade de uso de um padrão de referência, podemos dizer de maneira generalizada que a aquisição poderá ser dada mediante as seguintes fontes: Farmacopeias, Produtores Independentes (Axios Research Inc) e produzidos pela própria indústria (conhecidos como In House).
Geralmente a produção dos padrões de referência seguem 4 possibilidades básicas: (1) Adquirir o produto químico já pronto de um fornecedor existente, (2) Produzir através de síntese, (3) Produzir através de uma matéria prima que contenha o produto junto com outros compostos, processo de separação e purificação e (4) Extração natural. Entretanto, a questão mais empregada e reforçada pela ANVISA é a maneira de caracterização dos padrões. Independentemente de qual for a maneira de fabricação, o padrão de referência deverá conter um excelente certificado de análise. Sem dúvida alguma, as escolhas das análises, precisão e resolução dos equipamentos e o relatório técnico são os fatores principais para garantir que o padrão de referência esteja realmente apto a atender este extremo e importante uso dentro das indústrias farmacêuticas.